Novedades
Historias Relacionadas: La química y las pilas

10/02/2021 | Por el ingeniero Edgardo Remo Benvenuto Pérez
La Química y la Electricidad
Los fenómenos eléctricos se conocen desde hace siglos. Thales (≈ - 2600 años) describe atracciones y repulsiones entre cuerpos después de frotarlos. Un material usado para este fenómeno fue el ámbar (“elektron” en griego). La electricidad por frotamiento fue estudiada en el siglo XVIII y se propuso la “serie triboeléctrica” con dos tipos de electricidad, vítrea o resinosa, que se atraen o repelen según la posición relativa en la serie. Los dos tipos de cargas eléctricas luego se llamaron positiva o negativa. En 1785 Charles Coulomb (1736–1806) propone la ley de interacción electrostática entre dos cargas eléctricas puntuales: F = k . q1 . q2 / r2
F es interacción atractiva si las cargas eléctricas son de distinto signo o de repulsión si son de igual signo; q es cantidad de electricidad; r es la distancia entre las cargas puntuales. El valor de la constante de proporcionalidad k depende del medio entre q1 y q2.
Las ley de Coulomb y la ley de gravitación universal propuesta por Isaac Newton en 1685 son semejantes: F (interacción únicamente atractiva) = G . m1 . m2 / r2
Se señala que una masa origina propiedades en el espacio alrededor de la misma, se llama campo gravitatorio. El planeta Tierra tiene su campo gravitatorio que atrae (y viceversa) a todos los cuerpos. En la superficie de la Tierra la fuerza de atracción hacia su centro se llama peso: P = m . go
Una carga eléctrica origina un campo eléctrico a su alrededor e interacciona con otra carga eléctrica.
Hasta el siglo XIX la única fuente de guardar electricidad obtenida por frotamiento era la botella de Leyden que es un condensador, almacena energía eléctrica y sólo se descarga rápido: figura 1.
En 1800 Alessandro Volta (1745-1827) construyó el primer dispositivo que entrega energía eléctrica durante un tiempo, la pila química o voltaica, formada por una pila de elementos: figura 2.
Figura 1: cargando una botella de Leyden 
Figura 2: la pila química de Volta
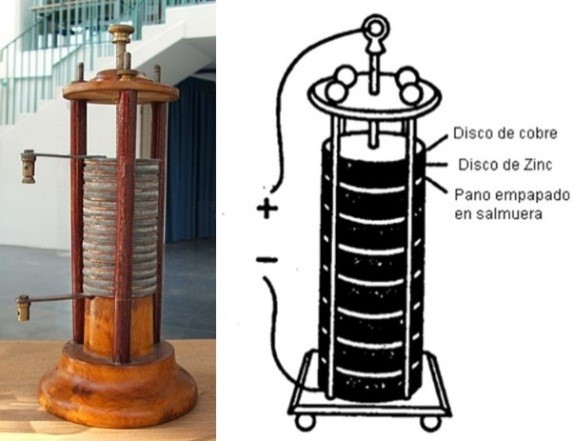
La pila de química de Volta hizo posible a M.Faraday (1791-1867) realizar trabajos experimentales y descubrimientos fundamentales, por ejemplo, fenómenos electroquímicos, electromagnéticos.
Constitución de una pila química.
Una pila química está formada por una semipila que entrega electrones, se oxida, y otra semipila que los recibe, se reduce, este movimiento de electrones se realiza por medio de electrodos sólidos (polo positivo + y polo negativo -) en un circuito exterior conductor de electricidad, en el interior de la pila las cargas eléctricas se mueven en un medio conductor de la electricidad.
La óxido-reducción es un fenómeno químico - físico clásico con intercambio de electrones.
En 1836 se inventa la pila de Daniell, formada por Zinc sólido Zn (s)- disolución acuosa de ión Zn2+ (ac), semipila de oxidación y Cobre sólido Cu (s) – disolución acuosa de Cu2+ (ac) de reducción.
Un avance muy importante fue la batería o acumulador de Plomo (G.Plante: 1859), es una pila química que se construye con 2 electrodos sólidos de plomo Pb (s) y el líquido conductor, “ácido sulfúrico” H2SO4 (ac): figura 3. Luego se carga con una fuente exterior y “acumula energía”. Al usarla como fuente de energía eléctrica se descarga pero se puede recargar y así sucesivamente, teóricamente se puede reciclar siempre. Un inconveniente de la batería de Pb es que el “ácido sulfúrico” es un líquido muy corrosivo.
Un serio inconveniente práctico de estas pilas es el cuerpo líquido que contienen.
En 1866 G.Leclanche inventa la “pila seca” que no contiene un líquido sino una pasta húmeda conductora: figura 4. Se señala que la pila seca no es recargable.
Figura 3: batería de Pb Figura 4: la pila seca
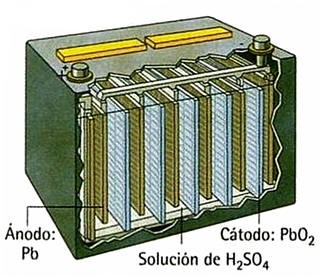
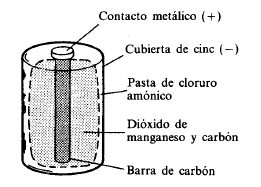
Se señala que los términos pila o batería es porque pila es 1 elemento (fig. 4) y batería son 2 o más en serie (fig. 3), pero se pueden usar ambos, pila o batería son fuentes de energía eléctrica.
En teoría todas las pilas o baterías químicas son recargables porque todos los fenómenos químicos clásicos son reversibles, pero según sus componentes, en algunos casos no es posible, por ejemplo, la pila seca no es recargable, la batería de plomo si es recargable.
Se destaca que cada pila química tiene una energía eléctrica determinada por su constitución y se relaciona con una propiedad que se mide en Voltios V, por ejemplo, la pila seca tiene 1,5 V, cada elemento del acumulador de Pb tiene 2 V.
El desarrollo de las pilas y las baterías.
El invento de la pila en 1800 (inicio del siglo XIX) hizo posible las investigaciones sobre la electricidad y el magnetismo, se descubrieron empíricamente leyes de la electrotecnia, se desarrollaron generadores y motores eléctricos sin conocer la partícula fundamental de la electricidad: el electrón, recién identificado a fines del siglo XIX.
En 1899 W.Jungner inventa una pila recargable de níquel Ni – cadmio Cd – hidróxido de potasio KOH (la batería de Pb es la primera recargable).
Desde el inicio del siglo XX y hasta aproximadamente hasta 1960, los aparatos que funcionaban con pilas no eran prácticos, se usaban pilas no recargables, en general la pila seca de 1,5 V, consumían mucha energía, por ejemplo, una radio portátil a válvulas electrónicas.
La batería de Pb recargable fue y es imprescindible para los automóviles, hasta ahora es irremplazable para varios desarrollos tecnológicos, por ejemplo, energía eólica, energía fotoeléctrica.
Desde aproximadamente 1960, el desarrollo de las fuentes químicas de energía eléctrica es muy importante y eficiente, especialmente en pilas recargables pequeñas que permiten el uso de distintos dispositivos electrónicos. Desde 1950 se inicia la microelectrónica con el invento del transistor (válvula sólida) y junto con el desarrollo de la informática, los aparatos electrónicos consumen poca energía, son pequeños y livianos.
Actualmente hay varias pilas recargables, por ejemplo, Ni – Cd, Ni – hidruro metálico MH, ión litio Li+, hacen posible el uso comercial de distintos aparatos, por ejemplo, teléfono celular, computadoras portátiles, marcapasos.
Otra fuente de energía eléctrica es la pila de combustible o celda de combustible (figura 5), así llamada porque la combustión es un fenómeno químico clásico de óxido-reducción, luego se puede usar como fuente de energía eléctrica. Si el combustible es hidrógeno H2 que se oxida y entrega electrones y el que se reduce y recibe electrones es el bioxígeno O2 , se forma agua H2O.
Estas pilas tienen tecnologías y costos elevados, todavía no son de uso común pero es posible que pronto se ofrezcan comercialmente.
Por sus características y ventajas, funcionan con H2 y O2 que se introducen en la pila, se agotan solo si no hay H2 y/o O2 y el producto es agua, fueron usadas en los viajes espaciales tripulados del programa Apolo a la Luna. Durante el viaje del Apolo 13 (abril de 1970), uno de los tanques de O2 explotó (figura 6). Se canceló el alunizaje pero los 3 tripulantes pudieron regresar a la Tierra.
Figura 5: pila de combustible
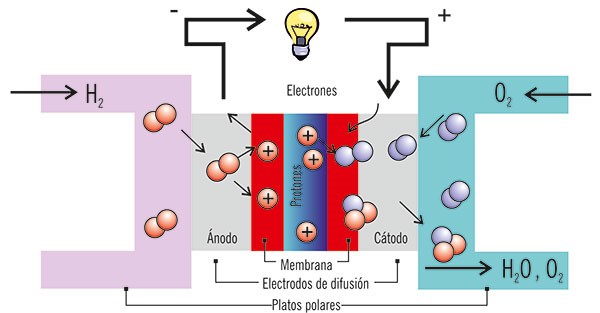
Figura 6: explosión en el Apolo 13

Pilas y baterías agotadas.
El uso masivo y creciente de aparatos que funcionan con pilas y baterías origina un serio problema ambiental, según el destino de las pilas y baterías agotadas, porque contienen muchas sustancias muy contaminantes del medio ambiente, por ejemplo, Ni, Cd, Hg, Zn, Hg, Pb, Fe. Obviamente no se deben mezclar con los desechos comunes. Es posible reciclarlas pero, en general, los métodos son complicados y económicamente no convenientes.
Una propuesta práctica y simple que prácticamente evita el contacto con el medio ambiente es confinar las pilas agotadas en hormigón.
Se debe promocionar el uso de pilas recargables que son convenientes económicamente y para el medio ambiente.
